Строение атома. Опыты Резерфорда

Цель урока: формировать понятие о количественной теории строения атома, которая позволила объяснить атомные спектры, открыть законы квантовой механики.
Ход урока
1. Анализ контрольной работы.
2. Изучение нового материала
Исследовав рассеяние α – частиц веществом Э. Резерфорд открыл атомное ядро.
Модель атома Томсона.
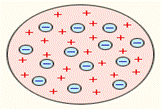
Дж. Томсон, открывший электрон, предложил и свою модель атома. Он полагал,
Например, атом водорода – это положительно заряженный шарик R = 10-8 см, внутри которого имеется электрон. У более сложных атомов в положительном шарике содержится несколько электронов. Атом подобен кексу, в котором роль изюминок играют электроны.
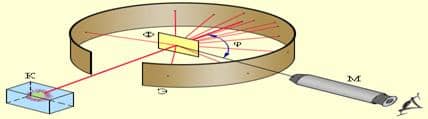
Опыты Резерфорда.
Зондирование атома с помощью α – частиц проделал Резерфорд в 1906 году, чтобы исследовать распределение положительного заряда и массы внутри атома.
α – частица – это полностью ионизированный атом гелия. Их масса в 8000 раз больше массы электрона, а скорость достигает 20000 км/с
Схема опыта рассматривается по плакату.
Результаты опытов.
При прохождении через фольгу частицы рассеивались, а некоторые (одна из 2000) отклонялась на углы большие 90⁰.
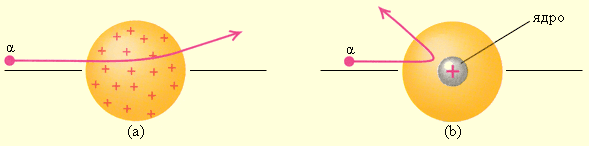
На основе опытов сделали следующие выводы:
1) атом имеет ядро, размеры которого малы по сравнению с размерами атома;
2) в ядре сконцентрирована почти вся масса атома;
3) отрицательный заряд всех электронов распределен по всему объему атома.
Выводы удивили, даже Резерфорда. Предвидеть такой результат на основе модели Томсона было невозможно. Оттолкнуть α – частицу размазанный по всему атому положительный заряд не мог. Напряженность электрического поля, созданного равномерно заряженным шаром максимальна на поверхности и минимальна в центре. Чем меньше R, тем больше сила отталкивания α – частицы.
Определение размеров ядра атома.
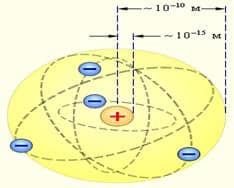
Используя результаты опытов, Резерфорд понял и предложил гипотезу об атомном ядре, которая впоследствии получила подтверждение. Ядро атома – это тело малых размеров, в котором сконцентрирована почти вся масса и весь положительный заряд атома.
Размер атома составляет 10-8 см; диаметр ядра 10-12 – 10-13см, т.е. размер атома > размера ядра в 10 – 100 тысяч раз.
Таким образом, была создана планетарная модель атома. Привести пример с вращением планет вокруг Солнца и сравнить с вращением электронов вокруг ядра атома.
Ядро атома водорода имеет положительный заряд и массу ≈ в 1836,1 раза больше, чем масса электрона. Это ядро получило название протон и обозначается символом – р. Размер атома – это радиус орбиты его электрона.
Несовместимость планетарной модели с законами классической физики.
1) Длительное движение электрона по орбите с точки зрения классической электродинамики невозможно, так как из – за потери энергии на излучение, электрон должен тормозится и очень скоро (t=10-8c) должен упасть на ядро. Между тем атом устойчив.
2) Вследствие непрерывной потери энергии атом должен излучать сплошной спектр. Однако атомы излучают линейчатые спектры.
3) Атомы излучают не все время, а лишь при определенных условиях, т.е. при возбуждении атома.
Из опытов Резерфорда вытекал вывод о гибели атомов за короткое время. Но ничего подобного не происходит. Просто вывод о прекращении существования атомов – это результат объяснения процессов происходящих внутри атома с помощью законов классической физики. От которых впоследствии пришлось отказаться.
3. Закрепление изученного материала
1) В чем суть модели атома Томсона?
2) Какие опыты поставил Резерфорд?
3) Какой неожиданный результат получил Резерфорд, исследовав опыты?
4) Каковы размеры атомного ядра?
5) Почему планетарная модель атома оказалась несовместимой с классической физикой?
Подведем итоги урока.
Домашнее задание: §96
