Квантовые постулаты Бора. Модель атома водорода по Бору. Квантовая механика
Цель урока: формировать представление учащихся, как на основе двух постулатов Бор определил энергию стационарных состояний атома и свойства его электронных оболочек.
Ход урока
1. Проверка домашнего задания методом индивидуального опроса.
1) Каким строение атома представляли ученые до опытов Резерфорда?
2) Почему результаты опытов стали неожиданными даже для Резерфорда?
3) Каковы размеры атомного ядра?
4) В чем суть планетарной модели атома?
5) Почему оказались несовместимы планетарная модель атома

2. Изучение нового материала
Дальнейшее развитие квантовых представлений о процессах в микромире получило в трудах датского физика Нильса Бора.
В 1913 году он нашел выход из сложного положения, в котором оказалась физика, выдвинув два постулата и сформулировав основные положения новой теории. Постулаты накладывали ограничения на некоторые законы классической физики.
Первый постулат Бора: атомная система может находиться только в особых квантовых (стационарных) состояниях, каждому из которых соответствует определенная энергия En; в стационарном состоянии атом не излучает.
Противоречия с классической физикой:
1) энергия движущихся электронов может быть любой;
2) движение электронов ускоренное, а излучение электромагнитных волн нет.
Второй постулат Бора: излучение света происходит при переходе атома из стационарного состояния с большей энергией Ek в стационарное состояние с меньшей энергией En. Энергия излученного фотона равна разности энергий стационарных состояний:
hνkn= Ek – En; νkn = QUOTE ![]()
![]() = QUOTE
= QUOTE ![]()
![]() ;
;
Противоречие с классической физикой: частота излучения свидетельствует только об изменении энергии атома.
Постулаты Бора были использованы для простейшей атомной системы – атома водорода.
Нахождение частот электромагнитных волн излучаемых водородом можно было найти, используя правило квантования ( которое снова приняли в виде постулата).
Модель атома водорода по Бору.
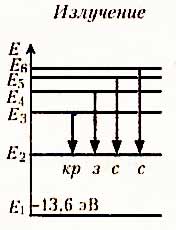
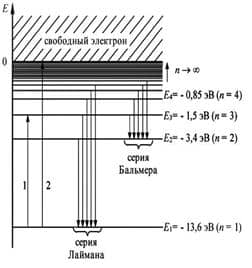
Используя законы механики Ньютона и правило квантования, Бор вычислил радиусы орбит электрона и энергии стационарных состояний для атома водорода. Размер атома – это минимальный радиус орбиты электрона. По плакату объяснить, как происходит излучение и поглощение света; и что все частоты излучений атома водорода представляют собой ряд серий, каждая из которых возникает при переходах атома в одно энергетическое состояние из всех состояний с большей энергией. Серия Бальмера – это переход в первое возбужденное состояние с верхних уровней.
Поглощение света – это процесс обратный излучению.

Трудности теории Бора.
Построить количественную теорию для атома гелия на основе положений Бора не удалось.
Новая теория оказалась внутренне противоречивой, использовались и квантовые постулаты, и законы классической физики. Нужно было перестраивать и механику и электродинамику.
Эта работа была проделана в 30 – е, 40 – е годы 20 века. Были созданы две новые физические теории: квантовая электродинамика и квантовая механика.
В настоящее время известны свойства электронных оболочек и строение атомов всех химических элементов.
3. Закрепление изученного материала.
1) Сформулировать постулаты Бора.
2) Найти противоречия постулатов с законами классической физики.
3) Что представляла собой модель атома водорода по Бору?
4) Какие две теории были созданы для объяснения свойств строения атомов?
Подведем итоги урока.
Домашнее задание: § 95, 96, повт. §94, упр. 13 № 1, 2.
