Примеры решения задач и упражнения к главе «Основы молекулярно-кинетической теории»
При решении большей части задач первой главы нужно уметь определить молярные массы веществ. Для этого по известным из таблицы Менделеева относительным атомным массам надо определить относительную молекулярную массу, а затем и молярную массу по формуле M = 10-3 Mr, кг/моль, где M — молярная масса; Mr — относительная молекулярная масса.
Во многих задачах требуется по известной массе тела определить количество вещества или число молекул (атомов) в нем. Для этого используются формулы: 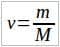 и
и 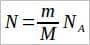
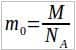 . В некоторых задачах массу вещества нужно выразить через его плотность Ρ и объем V.
. В некоторых задачах массу вещества нужно выразить через его плотность Ρ и объем V.При решении задач удобно иметь перед глазами указанные выше и все остальные формулы § 2.
В ряде задач используется основное уравнение молекулярно-кинетической теории в форме (1.17) или (1.18).
1. Определить молярную массу воды.
Решение. Относительная атомная масса водорода равна 1,00797, а кислорода 15,9994. Химическая формула воды H2O. Следовательно, относительная молекулярная масса воды равна:
Mr = 2 — 1,00797 + 15,9994 = 18,01534 ≈ 18.
Молярная масса воды M ≈ 10-3 — 18 кг/моль ≈ 0,018 кг/моль.
2. Определить количество вещества и число молекул, содержащихся в 1 кг углекислого газа.
Решение. Так как молярная масса углекислого газа M = 0,044 кг/моль, то количество вещества 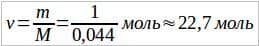 . Число молекул
. Число молекул  .
.
3. Молекулы газа, концентрация которых N = 2,7 — 1025 м-3, производят на стенки сосуда давление P = 105 Па. Какова средняя кинетическая энергия E поступательного движения молекул?  4. Плотность газа в баллоне газополной электрической лампы Ρ = 0,9 кг/м3. При горении лампы давление в ней возросло с p1 = 8 — 104 Па до p2 = 1,1 — 105 Па.
4. Плотность газа в баллоне газополной электрической лампы Ρ = 0,9 кг/м3. При горении лампы давление в ней возросло с p1 = 8 — 104 Па до p2 = 1,1 — 105 Па.
На сколько увеличилась при этом средняя скорость молекул газа?
Решение. Произведение массы M0 одной молекулы на концентрацию молекул (число молекул в единице объема) N равно массе молекул, заключенных в единице объема, т. е. плотности газа Ρ = m0n. Следовательно, основное уравнение молекулярно-кинетической теории (1.17) можно записать в виде:

Упражнения
Какую площадь может занять капля оливкового масла объемом 0,02 см3 при расплывании ее на поверхности воды? Считая диаметр атома вольфрама D ≈ 2 ∙ 10-10 м, оценить количество атомов, покрывающих поверхность острия иглы. Острие считать полушаром радиуса 5 ∙ 10-8 м. Определить молярные массы водорода и гелия. Во сколько раз число атомов в 12 кг углерода превышает число молекул в 16 кг кислорода? Каково количество вещества (в молях), содержащегося в 1 г воды? Чему равно число молекул в 10 г кислорода? Молярная масса азота равна 0,028 кг/моль. Чему равна масса молекулы азота? Определить число атомов в 1 м3 меди. Молярная масса меди M = 0,0635 кг/моль; ее плотность Ρ = 9000 кг/м3. Плотность алмаза 3500 кг/м3. Какой объем займут 1022 атомов этого вещества? Как изменится давление газа, если концентрация его молекул увеличится в 3 раза, а средняя скорость молекул уменьшится в 3 раза? Под каким давлением находится газ в сосуде, если средний квадрат скорости его молекул V2 = 106 м2/с2, концентрация молекул N = 3 ∙ 1025 м-3, масса каждой молекулы M0 = 5 ∙ 10-26 кг? В колбе объемом 1,2 л содержится 3 ∙ 1022 молекул гелия. Какова средняя кинетическая энергия каждой молекулы? Давление газа в колбе 105 Па. Вычислить средний квадрат скорости движения молекул газа, если его масса M = 6 кг, объем V = 4,9 м3 и давление P = 200 кПа.
