Строение атома
В 1897 г. было сделано открытие, позволившее объяснить большинство электрических явлений: английский ученый Дж. Дж. Томсон открыл частицу, являющуюся носителем элементарного заряда.
Эту частицу назвали Электроном.
Масса электрона оказалась почти в 2000 раз меньше массы самого легкого атома в природе — атома водорода. Заряд электрона отрицательный:
Qэл = — e = -1,6-10-19 Кл.
Этот заряд является неотъемлемой характеристикой электрона. В отличие от обычных тел, которые можно зарядить или, наоборот, разрядить, «избавить» электрон
Он всегда имеет одно и то же значение.
Из курса химии вы знаете, что электроны входят в состав атомов. Электроны внутри атома обращаются вокруг положительно заряженного атомного ядра.
Строение атома было открыто в 1911 г. в результате экспериментов, которыми руководил английский ученый Э. Резерфорд. Идея опытов состояла в том, чтобы выяснить, что происходит с быстролетящими частицами, когда на их пути оказываются атомы вещества.
Нужно сказать, что за несколько лет до этого было открыто явление Радиоактивности: были обнаружены невидимые лучи, которые испускались некоторыми (теперь их называют радиоактивными) веществами (ураном, радием и др.). Изучение этих лучей показало, что в общем случае они состоят из трех компонентов, отличающихся друг от друга электрическим зарядом. Для обозначения отдельных видов радиоактивных излучений было предложено использовать первые три буквы греческого алфавита: α (альфа), β (бета) и γ (гамма).
Альфа-лучи состоят из положительно заряженных частиц (альфа-частиц), бета-лучи — из отрицательно заряженных частиц (электронов), гамма-лучи — никаким зарядом не обладают. Эти лучи опасны для человека. Поэтому, работая с радиоактивными препаратами, следует соблюдать особые меры предосторожности: использовать специальные защитные экраны и, конечно, никогда не брать эти препараты руками. 
Резерфорд предложил использовать альфа-частицы в качестве тех «снарядов», которыми можно было бы «бомбардировать» атомы вещества. Направив узкий пучок этих частиц на тонкую пластинку (фольгу) исследуемого вещества, он обнаружил, что большинство альфа-частиц пролетало через фольгу почти беспрепятственно и лишь очень небольшая их часть, столкнувшись с чем-то внутри атома, отскакивала от фольги назад.
Более подробно об опытах Резерфорда будет рассказано в старших классах. Здесь же мы ограничимся тем выводом, к которому он пришел на основе анализа полученных данных.
Согласно Резерфорду, атом по своему строению напоминает Солнечную систему. Подобно тому как планеты, притягиваясь к Солнцу, движутся вокруг него, так и электроны в атоме движутся вокруг ядра, удерживаемые силами притяжения к нему. Из-за этого сходства модель строения атома (рис. 11), предложенную Резерфордом, назвали планетарной моделью.
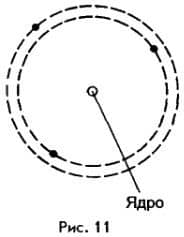 Расстояния между ядром и электронами очень велики по сравнению с размерами этих частиц. Если бы весь атом увеличился так, что ядро приняло бы размеры десятикопеечной монеты, то расстояние между ядром и электронами стало бы равным примерно километру!
Расстояния между ядром и электронами очень велики по сравнению с размерами этих частиц. Если бы весь атом увеличился так, что ядро приняло бы размеры десятикопеечной монеты, то расстояние между ядром и электронами стало бы равным примерно километру!
Подсчитано, что если бы все электроны примкнули вплотную к атомным ядрам, то объем тела взрослого человека стал бы равным одной миллионной доле кубического миллиметра! Это означает, что более 99% внутри тела человека (как и любого другого тела) занимает пустота! Именно через пустоту внутри атомов и пролетали те альфа-частицы в опыте Резерфорда, которые не отклонялись фольгой назад.
Совокупность атомов одного вида называют Химическим элементом. Атомы разных химических элементов отличаются друг от друга зарядом своих ядер и числом электронов, обращающихся вокруг них. Так, например, в атоме водорода движется всего лишь один электрон, в атоме кислорода — восемь электронов, в атоме урана — девяносто два.
Число электронов в атоме совпадает с порядковым номером элемента в таблице Д. И. Менделеева. Через этот же номер выражается и заряд атомного ядра. Введем обозначение:
Z — порядковый номер элемента = число электронов в атоме.
Тогда для заряда атомного ядра и общего заряда всех электронов в атоме можно записать:
Qядра = +Ze, qэл-нов = — Ze.
Сложив общий заряд электронов в атоме с зарядом атомного ядра, мы получим нуль. Это означает, что в целом атом нейтрален. Нейтральными являются и молекулы вещества, так как они состоят из нейтральных атомов.
В некоторых случаях (например, при столкновениях) атомы могут потерять один или несколько своих электронов. Вместе с электронами атомы теряют часть своего отрицательного заряда и перестают быть нейтральными. Образующийся в результате этого положительно заряженный атом называют Положительным ионом.
Бывают и обратные случаи: нейтральный атом присоединяет к себе лишний электрон и становится отрицательно заряженным. Такой атом называют Отрицательным ионом.
??? 1. Кто и когда открыл электрон? 2. Как заряжен электрон? 3. Вокруг чего обращаются электроны внутри атома? 4. Как заряжено атомное ядро? 5. Докажите, что атом в целом нейтрален.
6. Кто и когда открыл строение атома? 7. Чем отличаются альфа-, бета — и гамма-лучи друг от друга? 8. Приведите примеры радиоактивных веществ. 9. Почему большинство альфа-частиц в опыте Резерфорда практически беспрепятственно пролетало сквозь фольгу?
10. На что наталкивались внутри атома альфа-частицы, которые в опыте Резерфорда отскакивали от фольги назад? 11. Чем отличаются друг от друга атомы разных химических элементов?
12. Что представляют собой положительные и отрицательные ионы? Как они образуются?
