План-конспект урока по физике. Тема: Электрический ток в жидкостях и расплавах
Цель урока: сформулировать законы электролиза, сформировать у учащихся представление об ионной проводимости растворов электролитов.
Ход урока:
Проверка домашнего задания
1. Что собой представляет электрический ток в вакууме?
2. Как устроен, работает и где применяется вакуумный диод?
3. Свойства и применение электронных пучков.
4. Устройство, принцип действия и применения электронно – лучевой трубки.
5. Задача. В вакуумном диоде электрон подходит к аноду со скоростью 8 Мм/с.
Найти
Решение. e U= m V2/2; 2e U = m V2; U = m V2/2e; U = 182 B
Изучение нового материала
1. С помощью опыта доказываем, что жидкости могут быть проводниками, диэлектриками и полупроводниками.
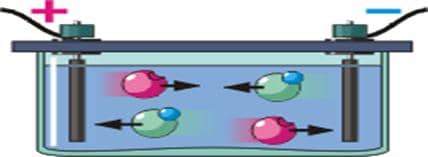
Растворы и расплавы электролитов: солей, кислот и щелочей относятся к проводникам.
Жидкие полупроводники – это расплавы сульфидов и другие.
Растворение электролитов, под влиянием электрического поля полярных молекул воды, сопровождается распадом молекул электролитов на ионы – электролитическая диссоциация.
Степень диссоциации зависит от концентрации раствора, от температуры, электрических свойств растворителя. Чем выше температура, тем больше степень диссоциации. Ионы разных знаков снова могут объединятся, в нейтральные молекулы. Носителями заряда в водных растворах или расплавах электролитов являются положительно и отрицательно заряженные ионы. Перенос заряда в водных растворах или расплавах электролитов осуществляется ионами, такую проводимость называют ионной. При ионной проводимости происходит перенос вещества. Процесс выделения на электроде вещества, связанный с окислительно – восстановительными реакциями, называют электролизом.
Применение электролиза: никелирование, хромирование и т. п.; гальваноскопия; гальванопластика; осуществление очистки металлов от примесей. Таким образом получают алюминий из расплава бокситов.
Масса выделившегося вещества: mi = m0i Ni; где Ni- число ионов. М0ν= М/NA – масса ионов.
Ni = Δq/q0i – число ионов, достигших электрода. Где q0i- заряд иона; Δq – заряд, протекший через электролит за время Δt. Δq = I·Δt; q0i= n е; поэтому:
m = M Δq/NA n е = M I Δt/NA n e
k = M/NA n е –коэффициент пропорциональности.
Формулировка закона электролиза: масса вещества, выделившегося на электроде за время Δt при прохождении электрического тока, пропорциональна силе тока и времени.
Закон электролиза был открыт Фарадеем, поэтому его называют также – закон Фарадея.
k – коэффициент пропорциональности, который называют электрохимический эквивалент.
k = m0i/q0i; измеряется в 1кг/Кл; е = M I Δt/ m n NA- заряд электрона
Закрепление изученного материала
№ 1. При гальваностегии пластины ее поверхность покрыли слоем никеля толщиной 0,05 мм. Определите среднюю плотность тока, если электролиз длился 2,5 часа.
![]() Дано: J = I/S; S – площадь сечения проводящей части электролита, равная площади
Дано: J = I/S; S – площадь сечения проводящей части электролита, равная площади
h = 0,05 мм пластины.
t = 2,5 ч Для нахождения силы тока применим объединенный закон Фарадея: m = AIΔt/Fn
J -? m = ρ V =ρ h S; где ρ –плотность никеля; S – площадь поверхности пластины.
Подставив, выражения найдем силу тока: I = ρ h S F n/A Δt
 Найдем плотность тока: J = ρ h S F n /A S Δt = ρ h Fn/A Δt; J = 160 (A/м2)
Найдем плотность тока: J = ρ h S F n /A S Δt = ρ h Fn/A Δt; J = 160 (A/м2)
Подведем итоги урока
Домашнее задание: § 122,123, ответить на вопросы 1-3 на стр. 308.
