Закон сохранения внутренней энергии и уравнение теплового баланса
Согласно уравнению (33.3), изменение внутренней энергии системы равно сумме работы внешних сил и количества теплоты, полученного системой:
ΔU = A + Q.
Из этого уравнения следует, что если систему тел изолировать от внешних воздействий, то ее внутренняя энергия будет оставаться неизменной, несмотря ни на какие процессы, происходящие внутри системы.
Действительно, в этом случае А = 0 и Q = 0. Поэтому ΔU = 0. Но если изменение внутренней энергии равно нулю, то, значит, внутренняя энергия является величиной постоянной.
Итак,
При любых процессах,
В этом заключается Закон сохранения внутренней энергии. Сохранение внутренней энергии у изолированной системы означает вечность теплового движения частиц, из которых состоит эта система.
Применим закон сохранения внутренней энергии к изолированной системе, состоящей из двух тел с разной температурой. При контакте этих тел между ними начнет происходить теплообмен. В процессе теплообмена более горячее тело будет отдавать энергию, а менее нагретое — ее получать. Это будет происходить до тех пор, пока температура тел не станет одинаковой.
Так как суммарная внутренняя энергия этих тел должна сохраняться, то, на сколько внутренняя энергия уменьшится при этом у одного тела, точно на столько же она возрастет у другого тела. Но, согласно формуле (33.2), изменение внутренней энергии каждого из этих тел равно количеству теплоты. Поэтому количество теплоты, отданное при теплообмене более горячим телом, будет равно по модулю количеству теплоты, полученному менее горячим телом:
Qпол =|Qотд|.
Это уравнение называют Уравнением теплового баланса.
Справедливость уравнения теплового баланса можно проверить на опыте. Смешаем в теплонепроводящем сосуде (сосуде Дьюара) воду массой m1 =0,8 кг, имеющую температуру t1 = 25 °С, с кипятком массой m2 = 0,2 кг (температура кипятка t2=100 °С). Измерив температуру полученной смеси через некоторое время, мы обнаружим, что она стала равной t=40 °С.
Вычислим количество теплоты, отданное горячей водой, и сравним его с количеством теплоты, полученным холодной водой. При остывании кипятка от 100 до 40 °С он отдает количество теплоты
Qотд = cm2(t-t2), Qотд=4200 * 0,2 * (40 — 100) Дж = -50400 Дж.
Вода же, в которую влили кипяток, нагреваясь от 25 до 40 °С, получает количество теплоты
Qпол = cm1(t-t1), Qпол = 4200 * 0,8 * (40 — 25) Дж = 50 400 Дж.
Мы видим, что действительно, количество теплоты, отданное при теплообмене горячей водой, равно по модулю количеству теплоты, полученному при этом холодной водой.
При проведении подобного опыта в школьных условиях вместо сосуда Дьюара используют более простой прибор, называемый Калориметром (рис. 75). Он состоит из двух сосудов, разделенных воздушным промежутком. Дно внутреннего сосуда отделено от внешнего специальной подставкой. Конечно, такой сосуд не может полностью помешать осуществлению теплообмена между содержимым сосуда и окружающей средой, но уменьшить его он может.
Если проводить опыт достаточно быстро, то можно добиться того, что количество теплоты, потерянное в процессе теплообмена с окружающей средой (и стенками калориметра), окажется весьма незначительным. 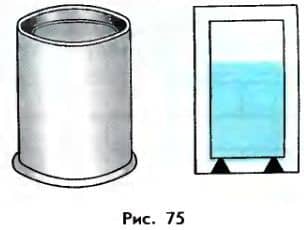
1. Сформулируйте и докажите закон сохранения внутренней энергии. 2. Выведите из закона сохранения внутренней энергии уравнение теплового баланса. 3. Почему в уравнении теплового баланса количество теплоты, отданное телом, берется по модулю? 4. Что представляет собой калориметр?
5. Почему при смешивании горячей и холодной воды в калориметре модуль количества теплоты, отданного горячей водой, оказывается не равным количеству теплоты, полученному холодной водой? Какое из них будет больше?
