Упражнения и итоги «Уравнение состояния идеального газа. Газовые законы»
Упражнения
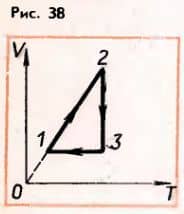
Газ сжат изотермически от объема V1 = 8 л до объема V2 = 6 л. Давление при этом возросло на Δp = 4 кПа. Каким было начальное давление p1? Компрессор, обеспечивающий работу отбойных молотков, засасывает из атмосферы V = 100 л воздука в секунду. Сколько отбойных молотков может работать от этого компрессора, если для каждого молотка необходимо v = 100 см3 воздуха в секунду при давлении p = 5 МПа? Атмосферное давление p = 100 кПа. Построить изотермы для 2 г водорода при 0°C в координатах p, V; V, T и p, T. Определить температуру газа, находящегося в закрытом
Краткие итоги главы III
Между термодинамическими параметрами существует связь, даваемая уравнением состояния. Все достаточно разреженные газы (идеальные газы) подчиняются уравнению состояния Менделеева-Клапейрона: 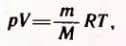 где p — давление, V — объем, m — масса газа, M — молярная масса, T — абсолютная температура, R = 8,31 Дж/(К*моль) — универсальная газовая постоянная.
где p — давление, V — объем, m — масса газа, M — молярная масса, T — абсолютная температура, R = 8,31 Дж/(К*моль) — универсальная газовая постоянная.
Уравнение состояния содержит в себе в качестве частных случаев газовые законы, связывающие изменение двух термодинамических параметров при неизменном значении третьего: для данной массы газа при T = const pV = const (закон Бойля-Мариотта); при p = const V = V0αT (закон Гей-Люссака), где V0 — объем при 0°C, α — температурный коэффициент объемного расширения, 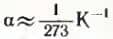 ; при V = const p = p0γT (закон Шарля), где p0 — давление при 0°C, а γ =
; при V = const p = p0γT (закон Шарля), где p0 — давление при 0°C, а γ = 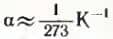 температурный коэффициент давления.
температурный коэффициент давления.
