Примеры решения задач к главе «Уравнение состояния идеального газа. Газовые законы»
В задачах на использование газовых законов встречаются обычно следующие ситуации:
А) известны макроскопические параметры в начальном состоянии газа и некоторые параметры в конечном состоянии.
Если при переходе из начального состояния в конечное один из параметров не меняется, то при изотермическом процессе можно пользоваться законом Бойля-Мариотта в форме (3.6) или в эквивалентной форме 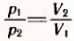 , следующей из (З.6). При изобарном процессе нужно пользоваться законом Гей-Люссака (3.8) или (3.7); при изохорном —
, следующей из (З.6). При изобарном процессе нужно пользоваться законом Гей-Люссака (3.8) или (3.7); при изохорном —
Если меняются все три параметра, то надо использовать уравнение состояния (3.4) или (3.5);
Б) известна часть макроскопических параметров в определенном состоянии газа. Надо найти неизвестные величины. В этих случаях удобнее всего пользоваться уравнением Менделеева-Клапейрона (3.4);
В) во многих задачах требуется построение графиков, изображавших разного рода процессы. Для построения графиков нужно знать зависимость параметров друг от друга. Эта зависимость в общем случае дается уравнением состояния, а в частных случаях — газовыми законами.
При решении всех задач надо четко представлять себе, каково начальное состояние системы и какого рода процесс переводит ее в конечное состояние.
1. Баллон вместимостью V1 = 0,02 м3, содержавший воздух под давлением p1 = 4 * 105 Па, соединяют с баллоном вместимостью V2 = 0,06 м3, из которого воздух выкачан. Найти давление P, установившееся в сосудах. Температура постоянна.
Решение. Воздух из первого баллона займет весь предоставленный ему объем V1 + V2.
По закону Бойля-Мариотта 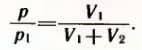 Отсюда искомое давление равно:
Отсюда искомое давление равно: 
2. На какую долю первоначального объема увеличится объем газа, находящегося при температуре t = 27°C, если нагреть его на 1°C при постоянном давлении?
Решение. Пусть V1 и T1 = 273 К + t = 300 К — первоначальные значения параметров состояния газа, V2 и T2 = T1 + 1 К — конечные значения тех же параметров.
По закону Гей-Люссака 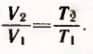 Равенство не изменится, если из левой и правой частей вычесть по единице:
Равенство не изменится, если из левой и правой частей вычесть по единице: 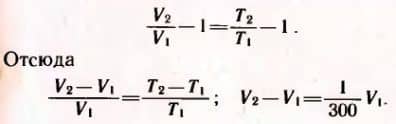
Объем газа увеличится на 1/300 долю первоначального.
3. Плотность воздуха при нормальных условиях (т. е. при t0 = 0°C и нормальном атмосферном давлении p0 = 101325 Па) ρ = 1,29 кг/м3. Найти среднюю молярную массу M воздуха.
Решение. Уравнение состояния идеального газа при нормальных условиях имеет вид: 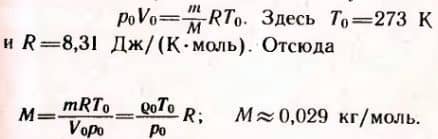
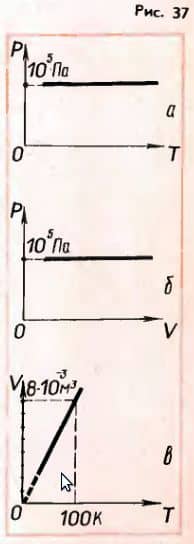 4. Построить изобары для 2 г водорода при нормальном атмосферном давлении p0 в осях p, T; p, V; V, T.
4. Построить изобары для 2 г водорода при нормальном атмосферном давлении p0 в осях p, T; p, V; V, T.
Решение. На графиках зависимости p от T и p от V изобара будет представлять собой прямую, параллельную либо оси T, либо оси V (рис. 37, а и б). 




 (1 votes, average: 5,00 out of 5)
(1 votes, average: 5,00 out of 5)Related posts:
- Газовые процессы 1. Изобарный процесс (при постоянном давлении) Экспериментальное изучение газов начнем с процессов, в которых один из трех макропараметров данной массы газа (давление p, объем V или температура T) не изменяется. Такие процессы называют изопроцессами. (От греческого слова «изос» — равный). Рассмотрим сначала процесс, который происходит при постоянном давлении. Его называют изобарным. (От греческого слова «изос» […]...
- Первый закон термодинамики 1. Внутренняя энергия газа Из курса физики основной школы вы знаете, что сумму кинетической энергии хаотического движения частиц и потенциальной энергии их взаимодействия называют внутренней энергией. Внутренняя энергия U данной массы одноатомного идеального газа равна произведению средней кинетической энергии одной молекулы на число молекул N: U = N. ? 1. Объясните, почему внутренняя энергия U […]...
- Применение первого закона термодинамики к газовым процессам 1. Изопроцессы и адиабатный процесс Напомним, что согласно первому закону термодинамики количество теплоты Q, переданное газу, связано с изменением внутренней энергии газа ∆U и работой газа Aг соотношением Q = ∆U + Aг. (1) Часто требуется применять первый закон термодинамики к газовым процессам, представляющим собой последовательность изопроцессов (иногда добавляется еще адиабатный процесс). Рассмотрим, как находить […]...
- Уравнение состояния идеального газа 1. Закон Авогадро Из уравнения Клапейрона (см. предыдущий параграф) следует, что в процессах, происходящих с данной массой газа, произведение давления газа p на его объем V, деленное на абсолютную температуру T газа, постоянно: (pV)/T = const. Однако если масса газа в процессе изменилось, то значение выражения (pV)/T тоже изменится! Это очень легко проверить. Поставим опыт […]...
- Применение уравнения состояния идеального газа к различным процессам С помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса и один из трех параметров — P, V или T — остаются неизменными. Количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра называют Газовыми законами. Процессы, протекающие при неизменном значении одного из параметров, называют Изопроцессами. (От греческого слова «изос» — равный.) […]...
- Применение уравнения состояния идеального газа 1. Учет гидростатического давления Сжатие воздуха в сосуде, погруженном в воду Рассмотрим следующую ситуацию. Пустую открытую стеклянную бутылку опускают в воду на глубину h. ? 1. Объясните, почему при погружении бутылки дном вниз воздух из нее выходит пузырьками и бутылка наполняется водой (рис. 46.1). ? 2. Почему при этом бутылка сразу тонет? ? 3. Объясните, […]...
- Упражнения и итоги «Уравнение состояния идеального газа. Газовые законы» Упражнения Газ сжат изотермически от объема V1 = 8 л до объема V2 = 6 л. Давление при этом возросло на Δp = 4 кПа. Каким было начальное давление p1? Компрессор, обеспечивающий работу отбойных молотков, засасывает из атмосферы V = 100 л воздука в секунду. Сколько отбойных молотков может работать от этого компрессора, если для […]...
- Уравнение состояния идеального газа Уравнение состояния. Мы детально рассмотрели поведение идеального газа с точки зрения молекулярно-кинетической теории. Была определена зависимость давления газа от концентрации его молекул и температуры (формула 2.10). На основе этой зависимости можно получить уравнение, связывающее все три макроскопических параметра P, V и T, характеризующие состояние данной массы достаточно разреженного газа. Это уравнение называют уравнением состояния идеального […]...
- План-конспект урока по физике. Тема: Температура и тепловое равновесие Цель урока: ввести понятие теплового равновесия, рассмотреть температуру как характеристику состояния теплового равновесия системы, познакомить учащихся со способами измерения температуры, обосновать необходимость газовой шкалы температур. Ход урока Проверка домашнего задания способом выполнения самостоятельной работы. Учащимся предложены задачи 2 – уровней сложности; выбирают уровень сложности по желанию. Задачи 1 – го уровня сложности. 1 Газ способен […]...
- Абсолютная температура и средняя кинетическая энергия молекул 1. Основное уравнение молекулярно-кинетической теории Идеальный газ. Если потенциальной энергией взаимодействия молекул в газе можно пренебречь по сравнению с кинетической энергией их хаотического движения, то можно считать, что вся внутренняя энергия газа — это сумма кинетических энергий его молекул. Такую упрощенную модель реального газа называют идеальным газом. Молекулярно-кинетическая теория идеального газа объясняет свойства газов, рассмотренные […]...
- План-конспект урока по физике. Тема: Идеальный газ Цель урока: познакомить учащихся с методом физического моделирования в молекулярно – кинетической теории, ввести простейшую модель реального газа – идеальный газ, вывести основное уравнение МКТ. Ход урока Проверка домашнего задания методом написания физического диктанта. 1. Относительной молекулярной массой называется… 2. Моль – это… 3. Количество вещества равно отношению… 4. Постоянная Авогадро равна… 5. Молекулярной массой […]...
- План-конспект урока по физике. Тема: Уравнение состояния идеального газа Цель урока: сформировать умение описывать состояние термодинамической системы данной массы газа с помощью трех макроскопических параметров: давления, объема, температуры; выяснить физический смысл универсальной газовой постоянной; развивать навыки решения задач. Ход урока Анализ самостоятельной работы. Изучение нового материала. Вывод уравнения состояния газа. (Выведем уравнение состояния, для любой массы газа, измеренной в молях. Для этого будем использовать […]...
- Работа в термодинамике Работа в механике и термодинамике. В механике работа определяется как произведение модулей силы и перемещения, умноженное на косинус угла между ними. Работа совершается при действии силы на движущееся тело и равна изменению кинетической энергии тела. В термодинамике движение тела как целого не рассматривается и речь идет о перемещении частей макроскопического тела друг относительно друга. В […]...
- Контрольная работа по теме: Молекулярно – кинетическая теория идеального газа Цель урока: проверить знания учащихся и выяснить степень усвоения материала данной темы. Ход урока Организационный момент. Вариант -1 (1 – го уровня) 1. Рассчитайте молекулярную массу кислорода — О₂. ( Ответ: 32·10-3 кг/моль) 2. Имеется 80 г кислорода, вычислить количество молей в нем. (Ответ: 2,5 моля) 3. Вычислить давление газа на стенки баллона, если известно, […]...
- Тепловые двигатели. Второй закон термодинамики 1. Принцип действия и основные элементы теплового двигателя В курсе физики основной школы вы уже познакомились с различными видами тепловых двигателей и их устройством. Тепловые двигатели сыграли большую роль в истории человечества и сохраняют огромное значение сегодня. Они движут автомобили, вращают турбины тепловых электростанций, разгоняют космические корабли. Принцип действия теплового двигателя Тепловые двигатели названы так […]...
- Примеры решения задач «Температура. Энергия теплового движения молекул» При решении задач этой главы используется формула (2.6), определяющая абсолютную температуру, формула (2.9), связывающая среднюю энергию хаотического движения с температурой, и формула (2.12) для средней квадратической скорости молекул. Некоторые задачи удобно решать, используя формулу (2.10), связывающую давление газа с концентрацией молекул и абсолютной температурой. Кроме того, нужно знать значение постоянной Больцмана (2.7). 1. Чему равно […]...
- Давление газа Мы знаем, что газы в отличие от твердых тел и жидкостей заполняют весь сосуд, в котором они находятся (например, стальной баллон для хранения газов, камеру автомобильной шины и т. д.). При этом газ оказывает давление на стенки, дно и крышку баллона или камеры, в которых он находится. Чем обусловлено это давление? Молекулы газа беспорядочно движутся. […]...
- План-конспект урока по физике. Тема: Газовые законы Цель урока: установить зависимость между двумя термодинамическими параметрами при неизменном значении третьего, формировать умение объяснять законы с молекулярной точки зрения, научится изображать графики изопроцессов. Ход урока Проверка домашнего задания. 1. Фронтальная беседа с классом — Что называется параметрами состояния? — Какие термодинамические параметры характеризуют состояние газа? — Какое состояние называется термодинамическим равновесием? — Почему в […]...
- Примеры решения задач и упражнения к главе «Основы молекулярно-кинетической теории» При решении большей части задач первой главы нужно уметь определить молярные массы веществ. Для этого по известным из таблицы Менделеева относительным атомным массам надо определить относительную молекулярную массу, а затем и молярную массу по формуле M = 10-3 Mr, кг/моль, где M — молярная масса; Mr — относительная молекулярная масса. Во многих задачах требуется по […]...
- Повторно – обобщающий урок по теме: Молекулярно – кинетическая теория идеального газа Цель урока; повторить и систематизировать знания по теме, совершенствовать умение логически мыслить, обобщать, решать качественные, графические и расчетные задачи. Ход урока Проверка домашнего задания в виде беседы с учащимися. 1. Какие явления рассматривает молекулярно – кинетическая теория? 2. Прокомментируйте основные положения МКТ. 3. Какими опытами были доказаны эти положения? 4. Модель какого вещества используется в […]...
- Насыщенный пар 1. Испарение и конденсация Как вы знаете, жидкости испаряются, то есть превращаются в пар. Например, лужи после дождя высыхают. Испарение жидкости обусловлено тем, что некоторые ее молекулы благодаря толчкам своих «соседей» приобретают кинетическую энергию, достаточную для того, чтобы вырваться из жидкости. В результате испарения над поверхностью жидкости всегда находится пар, Это газообразное состояние вещества. Водяной […]...
- Закон Архимеда. Плавание тел Вы уже знаете, что внутри жидкости в любой точке существует гидростатическое давление. Поэтому если внутрь жидкости в сосуде поместить тело (например, шар), то на все точки его поверхности будут действовать силы гидростатического давления (рис. 165, а). Определим сумму этих сил. Для этого рассмотрим второй такой же сосуд, заполненный, как и первый, такой же жидкостью (рис. […]...
- Расчет массы и объема тела Для того чтобы определить плотность вещества, надо массу тела разделить на его объем: (10.1) Массу тела можно определить с помощью весов. А как найти объем тела? Если тело имеет форму прямоугольного параллелепипеда (рис. 24), то его объем находится по формуле V = аbс. Если же у него какая-то другая форма, то его объем можно найти […]...
- Внутренняя энергия Из курса физики VII класса известно, что любое макроскопическое тело обладает внутренней энергией. Понятие внутренней энергии макроскопических тел играет важнейшую роль при исследовании тепловых явлений. Это обусловлено существованием фундаментального закона природы — Закона сохранения энергии. Открытие закона сохранения энергии стало возможным после того, как было доказано, что наряду с механической энергией микроскопические тело обладают еще […]...
- Идеальный газ в молекулярно-кинетической теории Идеальный газ. Идеальный газ с точки зрения молекулярно-кинетической теории простейшая физическая модель реального газа. Под моделью в физике понимают не увеличенную или уменьшенную копию реального объекта. Физическая модель — это создаваемая учеными общая картина реальной системы или явления, которая отражает наиболее существенные, наиболее характерные свойства системы. В физической модели газа принимаются во внимание лишь те […]...
- Измерение температуры Термометры. Для измерения температуры можно воспользоваться изменением любой макроскопической величины в зависимости от температуры: объема, давления, электрического сопротивления и т. д. Чаще всего на практике используют зависимость объема жидкости (ртути или спирта) от изменения температуры. При градуировке термометра обычно за начало отсчета (0) принимают температуру тающего льда; второй постоянной точкой (100) считают температуру кипения воды […]...
- План-конспект урока по физике. Тема: Работа в термодинамике Цель урока: вывести формулу для определения работы расширяющегося газа при постоянном давлении, познакомить учащихся с геометрической интерпретацией работы для изобарного процесса и в случае, когда Р‡соnst Ход урока Проверка домашнего задания методом фронтального опроса 1. Что изучает термодинамика? 2. Что называется внутренней энергией? Может ли тело обладать внутренней энергией, но не иметь механической энергии? Может […]...
- Лабораторные работы по физике, 10 класс 6. Опытная проверка закона Бойля-Мариотта Цель работы: проверить на опыте обратно пропорциональную зависимость между давлением газа и его объемом при постоянной температуре. Оборудование: стеклянная трубка с пробкой, гибкая трубка (например, резиновая) длиной около 1,5 м, стеклянная или прозрачная пластмассовая воронка, метровая линейка, два штатива с лапками. Описание работы В один конец гибкой U-образной трубки (рис. […]...
- Применение первого закона термодинамики к различным процессам С помощью первого закона термодинамики можно делать важные заключения о характере протекающих процессов. Рассмотрим различные процессы, при которых одна из физических величин остается неизменной (изопроцессы). Пусть система представляет собой идеальный газ. Это самый простой случай. Изохорный процесс. При изохорном процессе объем не меняется и поэтому работа газа равна нулю. Изменение энергии согласно уравнению (4.11) равно […]...
- Реактивное движение. Освоение космоса 1. Реактивное движение Из закона сохранения импульса следует: чтобы разогнаться, надо что-то оттолкнуть назад. Например, когда человек разбегается, он ногами толкает назад дорогу; автомобиль толкает назад дорогу вращающимися ведущими колесами; гребец веслом толкает назад воду. А что можно оттолкнуть назад, когда вокруг ничего нет — как у ракеты в открытом космосе? В таком случае надо […]...
- Агрегатные состояния вещества Зимой вода на поверхности озер и рек замерзает, превращаясь в лед. Подо льдом вода остается жидкой (рис. 76). Здесь одновременно существуют два различных состояния воды — твердое (лед) и жидкое (вода). Существует и третье состояние воды — газообразное: невидимый водяной пар находится в окружающем нас воздухе.На примере воды мы видим, что вещества могут находиться в […]...
- План-конспект урока по физике. Тема: Внутренняя энергия Цель урока: сформировать представление о внутренней энергии тела как функции состояния тела, установить зависимость внутренней энергии идеального газа от макроскопических параметров, продолжить формирование умения применять полученные знания при решении задач. Ход урока Изучение нового материала 1. Знакомство с целями и задачами термодинамики, изучающей тепловые процессы без учета молекулярного строения тел. 2. Законы термодинамики были записаны […]...
- М. Ю. Лермонтов «Герой нашего времени» Во всякой книге предисловие есть первая и вместе с тем последняя вещь; оно или служит объяснением цели сочинения, или оправданием и ответом на критики. Но обыкновенно читателям дела нет до нравственной цели и до журнальных нападок, и потому они не читают предисловий. А жаль, что это так, особенно у нас. Наша публика так еще молода […]...
- Решение задач по теме «Молекулярно – кинетическая теория идеального газа» Цель урока: развивать навыки решения задач на определение макроскопических и микроскопических параметров молекул, продолжить формирование умений самостоятельно мыслить, анализировать, проводить математические преобразования. Ход урока Проверка домашнего задания методом работы беседы, самостоятельной работы Беседа с учащимися: — Каким образом можно рассчитать среднюю скорость молекулы газа, зная его температуру? — Приведите примеры значений средних скоростей молекул газов […]...
- Строение газообразных, жидких и твердых тел Молекулярно-кинетическая теория дает возможность понять, почему вещество может находиться в газообразном, жидком и твердом состояниях. Газ. В газах расстояние между атомами или молекулами в среднем во много раз больше размеров самих молекул (рис. 10). Например, при атмосферном давлении объем сосуда в десятки тысяч раз превышает объем находящихся в сосуде молекул газа. Газы легко сжимаются, так […]...
- Контрольная работа по теме: Основы термодинамики Цель урока: проконтролировать знания и умения учащихся, приобретенные ими при изучении данной темы. Ход урока Организационный момент. Выполнение контрольной работы. Вариант – 1 (уровень – 1) 1. При передаче газу количества теплоты 2·104 Дж он совершил работу равную 5·104 Дж. Вычислить на сколько изменилась внутренняя энергия газа. Что при этом произошло с газом? (Нагрелся или […]...
- Абсолютная температура. Температура — мера средней кинетической энергии молекул Абсолютный нуль температуры. Температура, определяемая формулой (2.6), очевидно, не может быть отрицательной, так как все величины, стоящие в левой чисти (2.6), заведомо положительны. Следовательно, наименьшее возможное значение температуры T есть T = 0, когда либо давление P, либо объем V равны нулю. Предельную температуру, при которой давление идеального газа обращается в нуль при фиксированном объеме […]...
- Количество теплоты Изменить внутреннюю энергию газа в цилиндре можно не только совершая работу, но и нагревая газ (рис. 43). Если закрепить поршень, то объем газа не будет изменяться, но температура, а следовательно, и внутренняя энергия будут возрастать. Процесс передачи энергии от одного тела к другому без совершения работы называют теплообменом или теплопередачей. Энергию, переданную телу в результате […]...
- Применение уравнения теплового баланса 1. Первый закон термодинамики и уравнение теплового баланса До сих пор мы рассматривали первый закон термодинамики применительно к газам. Отличительной особенностью газа является то, что его объем может значительно изменяться. Поэтому согласно первому закону термодинамики переданное газу количество теплоты Q равно сумме совершенной газом работы и изменения его внутренней энергии: Q = ∆U + Aг. […]...
- Основное уравнение молекулярно-кинетической теории газов Вычислим с помощью молекулярно-кинетической теории давление газа. Вывод формулы для давления не очень сложный, но довольно громоздкий. Разобьем его на отдельные этапы. Пусть газ находится в прямоугольном сосуде ABCD, одна из стенок которого представляет собой поршень CD, способный перемешаться без трения (рис. 21). Причем газ и сосуд имеют одинаковые температуры. Вычислим давление газа на поршень […]...