Уравнение состояния идеального газа
1. Закон Авогадро
Из уравнения Клапейрона (см. предыдущий параграф) следует, что в процессах, происходящих с данной массой газа, произведение давления газа p на его объем V, деленное на абсолютную температуру T газа, постоянно: (pV)/T = const.
Однако если масса газа в процессе изменилось, то значение выражения (pV)/T тоже изменится! Это очень легко проверить.
Поставим опыт Надуйте щеки (рис. 40.1). При этом одновременно увеличились и давление воздуха во рту, и его объем, а температура этого воздуха осталась практически неизменной (равной температуре
Следовательно, значение выражения (pV)/T увеличилось. Причина, конечно, в том, что при надувании щек увеличивается масса воздуха во рту. 
От чего же зависит значение отношения (pV)/T? Может, только от массы газа?
Оказывается, что это не так: опыт показывает, что если для различных газов сделать одинаковым значение отношения (pV)/T, то массы газов могут сильно различаться. На рисунке 40.2 схематически изображены воздушные шарики одинакового объема, наполненные водородом, гелием, кислородом и радоном при одинаковых температуре и давлении. (Из дальнейшего вы догадаетесь, почему масса водорода взята равной 2 г.) 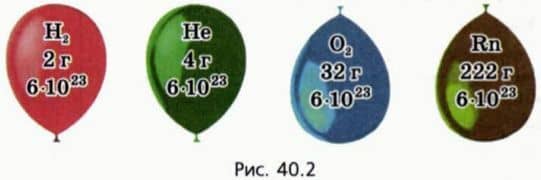
Ответ на вопрос, от чего зависит значение выражения (pV)/T, оказался на удивление простым. Его нашел в начале 19-го века итальянский ученый Амедео Авогадро.
Исследуя химические реакции между газами, он открыл закон, который называют сегодня законом Авогадро:
В равных объемах различных газов при одинаковых температурах и давлениях содержится одинаковое число молекул.
Отсюда следует, что значение выражения (pV)/T для данной массы газа пропорционально только числу молекул:
(pV)/T = kN,
Где k — коэффициент пропорциональности, одинаковый для всех газов. Его назвали настоянной Больцмана в честь австрийского физика Людвига Больцмана.
Измерения показали, что
K = 1,38 * 10-23 Дж/К.
Из закона Авогадро следует, что главной характеристикой газа является число молекул.
2. Единица количества вещества
Число молекул в образце вещества характеризуют физической величиной, которую называют количеством вещества и обозначают греческой буквой ν (произносится «ню»). (Это исторически сложившееся название может ввести в заблуждение, потому что его легко спутать с массой образца. Количество вещества надо понимать именно как характеристику числа молекул!)
Единицу количества вещества называют моль.
Один моль — это такое количество вещества, которое содержит столько же молекул, сколько атомов в 12 г углерода.
? 1. Во сколько раз число молекул в шести молях водорода больше, чем в двух молях кислорода?
? 2. Сколько молей водорода и кислорода нужно для того, чтобы в результате реакции между ними образовалось 2 моль воды? Подсказка. Вспомните химическую формулу воды.
Скоро мы поймем, почему ученые выбрали «произвольное» на первый взгляд определение моля.
Атомная единица массы
Массы атомов и молекул можно выражать в граммах: например, масса самого легкого атома (водорода) равна 1,67 * 10-24 г. Но это неудобно: получаются громоздкие числа.
В качестве атомной единицы массы (сокращенно а. е. м.) взяли величину, близкую к массе атома водорода, а именно 1/12 массы атома углерода: 
Такой выбор атомной единицы массы был обусловлен соображениями удобства при расчетах: во-первых, углерод входит в очень большое число химических соединений, во-вторых, при таком выборе атомной единицы массы значения масс многих атомов оказываются близкими к целым числам.
Сколько молекул а одном моле?
По определению в одном моле любого вещества содержится столько же молекул, сколько атомов в 12 г углерода. Значит, чтобы найти число молекул в одном моле, надо разделить 12 г, то есть массу одного моля углерода, на массу одного атома углерода, равную 12 а. е. м. В результате получим: 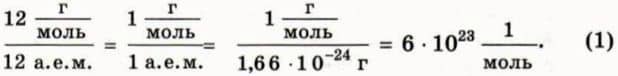 Число молекул в одном моле называют постоянной Авогадро (обозначают NA) и записывают в виде
Число молекул в одном моле называют постоянной Авогадро (обозначают NA) и записывают в виде
NA = 6 * 1023 моль-1. (2)
Сколько молекул в образце вещества, содержащем ν молей? В каждом моле NA молекул. Следовательно, число N молекул в образце, содержащем ν молей, выражается формулой
N = νNA. (3)
? 3. Сколько молекул содержится: а) в 2 моль воды? б) в 5 моль кислорода? в) в 0,33 моль углекислого газа?
Есть ли в условии лишние данные?
? 4. Сколько молей в образце вещества, число молекул в котором равно: а) 6 * 1024; б) 3 * 1022; в) З, З * 1022; г) 6 * 1020?
Относительная атомная и молекулярная масса
Массу атома, выраженную в атомных единицах массы, называют относительной атомной массой.
Относительные массы всех атомов измерены. Вы можете найти их в Периодической системе химических элементов (таблице Менделеева, стр. 238-239).
Приведенное в ней значение часто округляют до целого числа.
Например, относительная атомная масса водорода равна 1, гелия — 4, а кислорода — 16.
Аналогично относительной атомной массе определяют и относительную молекулярную массу: она равна массе молекулы, выраженной в атомных единицах массы.
Чтобы найти относительную молекулярную массу молекулы данного вещества, надо знать: — химическую формулу этого вещества, то есть из каких атомов состоит молекула вещества, — относительные атомные массы этих атомов.
Например, относительная молекулярная масса воды равна 18, потому что молекула воды состоит из одного атома кислорода и двух атомов водорода.
? 5. Чему равна относительная молекулярная масса: а) водорода? б) гелия? в) кислорода?
г) углекислого газа?
3. Молярная масса
Массу одного моля вещества называют малярной массой и обозначают M.
Найдем молярную массу воды. Для этого массу m0 молекулы воды (18 а. е. м.) умножим на число молекул в одном моле, то есть на постоянную Авогадро NA. Согласно формуле (1) значение постоянной Авогадро равно отношению 1 г к 1 а. е. м., поэтому для молярной массы воды получаем: 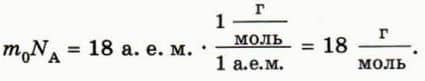
Следовательно, полстакана воды (примерно 100 г) — это около 5,5 моль воды (рис. 40.3). 
Обратите внимание: масса одного моля, выраженная в граммах, численно равна относительной молекулярной массе.
Это справедливо как для воды, так и для любого вещества, потому что для него можно провести точно такой же расчет молярной массы.
Равенство численного значения массы одного моля вещества (в граммах) и относительной молекулярной массы этого вещества не случайно: оно обусловлено тем, что в одном моле столько молекул, сколько атомных единиц массы в одном грамме. Это оказалось очень удобным для расчетов при проведении опытов, потому что массу образцов веществ измеряют часто в граммах.
В СИ молярную массу измеряют в кг/моль. Переводя граммы в килограммы, получаем для молярной массы воды:
MH2O = 18 * 10-3 кг * моль-1.
? 6. Чему равна молярная масса: а) водорода? б) кислорода? в) углекислого газа?
Воздух представляет собой смесь различных газов, главным образом — азота и кислорода. При решении задач воздух часто считают газом с молярной массой
Mвозд = 29 * 10-3 кг * моль-1.
? 7. Объясните, почему масса образца вещества m, его молярная масса M и число молей ν в данном образце связаны соотношением
Ν = m/M. (4)
? 8. Сколько молей: а) в одном литре воды? б) в 1 кг поваренной соли? в) в воздухе, занимающем объем классной комнаты шириной 5 м, длиной 10 м и высотой 4 м? Плотность воздуха при комнатной температуре и атмосферном давлении равна 1,2 кг/м3.
? 9. Объясните, почему массу m0 молекулы вещества можно выразить через его молярную массу M формулой
M0 = M/NA. (5)
? 10. Чему равна масса одной молекулы воды?
? 11. Объясните, почему число N молекул в образце вещества массой m можно найти с помощью соотношений
N = νNA = (m/M)NA.
? 12.Оцените число молекул в капельке воды радиусом 1 мм. Сравните найденное число молекул с числом звезд в галактике, содержащей сто миллиардов звезд (рис. 40.4).

? 13. Почему изображенные на рисунке 40.2 шарики имеют равные объемы при одинаковых температурах и давлениях?
4. Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
Вернемся теперь к соотношению (pV)/T = kN.
? 14. Объясните, почему справедлива формула
(pV)/T = (m/M)kNA. (6)
Произведение постоянной Больцмана k на постоянную Авогадро NA называют универсальной газовой постоянной и обозначают R:
R = kNA = 8,31 Дж/(моль * К).
Используя универсальную газовую постоянную, уравнение (6) можно переписать в виде
PV = (m/M)RT. (7)
Это соотношение называют уравнением состояния идеального газа.
Дело в том, что модель идеального газа (которую мы рассмотрим в следующем параграфе) хорошо описывает уже известные нам свойства всех достаточно разреженных газов, например окружающего нас воздуха.
Уравнение идеального газа в виде формулы (7) предложил русский ученый Дмитрий Иванович Менделеев, поэтому его называют также уравнением Менделеева-Клапейрона. 
Какие же задачи можно решать с помощью уравнения состояния идеального газа?
Плотность газа. Напомним, что плотность ρ = m/V.
? 15. Объясните, почему уравнение состояния идеального газа можно записать в виде
P = (ρ/M)RT.
Во многих задачах используют понятие нормальных условий для газа. По определению такими условиями называют давление 105 Па и температуру 0 ºС = 273 К.
? 16. Чему равна плотность воздуха: а) при нормальных условиях? б) при давлении 105 Па и комнатной температуре (20 ºС)?
Концентрация молекул газа. Концентрацией молекул и называют число молекул в единице объема. Ее можно выразить через число молекул N в данной массе газа и объем газа V:
N = N/V.
Концентрация молекул измеряется в 1/м3. Зная концентрацию молекул и объем газа, можно найти число молекул в нем.
? 17. Объясните, почему уравнение состояния идеального газ» можно записать в виде
P = nkT.
? 18. Рассмотрим газ при нормальных условиях. а) Чему равна при этом концентрация молекул? б) Различаются ли концентрации молекул различных газов при нормальных условиях? Обоснуйте свой ответ.
в) Сколько молекул воздуха вы вдыхаете при глубоком вдохе при 0 ºС, если объем легких увеличивается при этом на 2 л? Давление в легких считайте равным атмосферному.
Изменение массы газа. Из уравнения состояния идеального газа следует, что для одного и того же газа значение выражения (pV)/T пропорционально массе газа.
? 19. Гелий в баллоне с неплотно закрытым краном нагрели от 0 ºС до 20 ºС. При этом давление газа увеличилось от 2,2 * 105 Па до 2,3 * 105 Па.
Объем баллона 100 л. а) Во сколько раз увеличилась абсолютная температура газа? б) Во сколько раз увеличилось давление газа? в) Осталось ли неизменным значение выражения (pV)/T? г) На сколько уменьшилось число молей газа?
д) Насколько уменьшилась масса газа?
Изменение числа молекул вследствие изменения состава молекулы. Значение выражения (pV)/T пропорционально числу молекул, поэтому оно изменяется, если масса газа остается неизменной, но изменяется число молекул.
? 20. При нагревании водорода от 300 К до 1350 К все молекулы распались на атомы. Начальное давление равно атмосферному. Объем сосуда не изменился. а) Во сколько раз увеличилась абсолютная температура газа?
б) Во сколько раз увеличилось число молекул газа? в) Каким стало давление газа?
Дополнительные вопросы и задания
21. Сколько молей вещества: а) в ванне воды (200 л)? б) в баллоне, содержащем 100 г кислорода? в) в кубическом кристалле поваренной соли с длиной ребра 3 см?
Плотность поваренной соли 2,2 * 102 кг/м3.
22. Сколько молекул: а) в литре воды? б) в баллоне, содержащем 100 г углекислого газа (CO2)? в) в чайной ложке поваренной соли (6 г)?
23. Чему равна масса: а) 6 * 1023 молекул водорода? б) 3 * 1024 молекул воды? в) 4,2 * 1022 атомов кислорода?
24. В 1 г некоторого двухатомного газа содержится 2,14 * 1022 молекул. а) Чему равна молярная масса газа? б) Какой это газ?
25. Какой высоты слой воды покрыл бы земной шар, если бы на него вылили столько же чайных ложек воды (по 5 мл), сколько молекул воды содержится в одной чайной ложке? Площадь поверхности земного шара примите равной 500 млн км2.
26. Имеются алюминиевый и медный кубики. В каком из них больше атомов, и во сколько раз больше, если у них: а) равные массы? б) равные объемы? Примите, что плотность алюминия составляет 0,3 от плотности меди.
27. Полный стакан воды (200 мл) полностью испарился за 10 дней. Сколько молекул воды покидало стакан ежесекундно? Сравните это число с населением Земли.
28. В бассейн глубиной 2 м, длиной 50 м и шириной 10 м бросили один кристаллик поваренной соли массой 0,1 г. Спустя очень длительное время из бассейна зачерпнули стакан воды. Сколько ионов натрия окажется в атом стакане?
29. Одинакова ли концентрация молекул газов, содержащихся в шариках, изображенных на рисунке 40.2 (с. 22)? Чему она равна при нормальных условиях?
30. В цилиндре под постоянным давлением находился озон (трехатомный кислород O3) при температуре 727 ºС. Когда температуру понизили до 127 ºС, весь озон превратился в кислород O2. Как изменился объем газа?
31. В расположенном вертикально цилиндрическом сосуде с площадью поперечного сечения 10 см2 под поршнем с грузом общей массой 40 кг находится 0,05 молей газа. Температура газа 27 ºС, давление атмосферы 105 Па. а) Чему равно давление газа?
б) На какой высоте от дна сосуда находится поршень?
32. Цилиндрический сосуд разделен тонким подвижным поршнем на две части. В одной части сосуда находится 1 г водорода, а в другой — 1 г кислорода. Давление и температура газов одинаковы.
Какую часть сосуда занимает водород?
